南湖新闻网讯(通讯员 冯明霞)近日,Molecular Cell在线发表了我校与和哥本哈根大学的合作研究成果,题为“Structure of the Cmr-β Complex Reveal the Regulation of the Immunity Mechanism of Type III-B CRISPR-Cas”。该研究结合结构解析与生化实验数据,阐明了III-B 型Cmr-β复合物避免自身免疫与同源靶标RNA激活免疫的机制。
CRISPR-Cas系统是原核生物中由小RNA介导的获得性免疫系统,用于抵御外源移动遗传元件。根据复合物中的标志Cas蛋白,CRISPR-Cas系统被划分为I~VI型,其中I、III和VI型的RNP复合物含多种不同功能的Cas蛋白,归类为Class 1;而II、IV和V型只有单体多功能的Cas蛋白,归类为Class 2。
III型系统具有多种免疫活性,分别为靶标RNA间隔6碱基切割活性,同源靶标RNA激活的单链DNA切割活性与环状寡聚腺苷酸(cyclic oligoadenylates, cOA)合成活性。III-A(Csm)与III-B(Cmr)系统作为III型系统目前发现的两个大亚类型,现只有报道研究III-A型复合物被同源靶标RNA激活的分子机理,但对于III-B型复合物的系统性机理研究目前还比较少。
作者从冰岛硫化叶菌中纯化内源完整的Cmr-β复合物。该复合物解析得到2.75Å的Cryo-EM结构,该结构显示,Cmr-β复合物是一个特殊CRISPR-Cas免疫系统,它含有7种不同蛋白亚基,由37个亚基和一条crRNA组成,其组成成分比例为Cmr11-21-31-44-53-61-726-crRNA1。作者发现,与其他III型复合物不同,Cmr-β复合物的中心结构中的每个亚基均被由两个Cmr7形成的二聚体覆盖(如图 1E 和 F)。该III-B型复合物是目前发现的亚基数最多的、分子量最大的CRISPR效应子复合物。
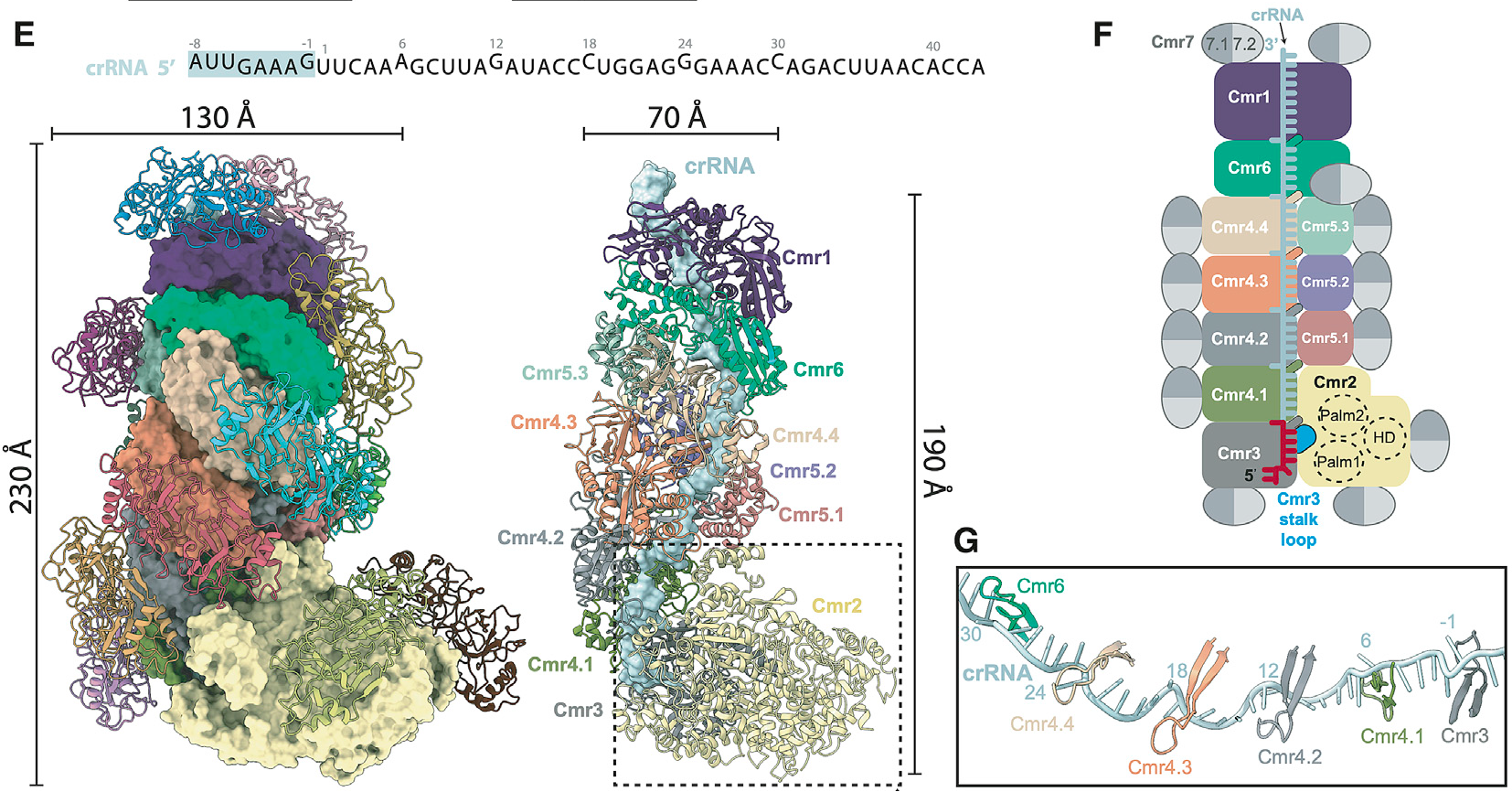
图1
迄今发现的III型系统具有的同源靶标RNA激活的活性是单链DNA切割活性和cOA合成活性。该研究的作者首次发现,除了以上两种激活活性,Cmr-β复合物还同时具有一个新的核酸干涉活性,即非特异性单链RNA切割活性。
先前的研究表明,III-A型的Csm复合物通过Cas10家族蛋白—Csm1中的一个Linker和loop L1结构参与区分同源和非同源靶标RNA7。然而这些结构在III-B型的Cas10蛋白-Cmr2中并不保守。为了理解III-B复合物如何区分同源靶标RNA和非同源靶标RNA,避免自身免疫机制,作者纯化了靶标RNA切割活性失活的突变体(4βD31A-β),并解析了该突变体+非同源靶标RNA或同源靶标RNA的Cryo-EM结构(3.1Å和3.5Å)。通过结构比较,作者发现,存在于Cmr3中的一个颈环(stalk loop)在这三个结构中呈现不同的构象:在复合物结构里呈现“延伸”,复合物结合非同源靶标RNA后发生旋转,呈“回缩”,结合同源靶标RNA后,消失“不可见”。通过序列比对,作者发现,这个颈环结构保守的存在于III-B系统中。作者指出,III-B复合物与非同源RNA结合后,其crRNA 5’ tag和非同源RNA 3’ antitag互补配对后,Cmr3中的颈环锁定在“回缩”状态,传达一种“自我”的信号,从而避免自身免疫。
为了进一步揭示同源靶标RNA激活Cmr-β复合物免疫的分子机制(即cOA合成,单链核酸切割),作者解析了4βD31A-β复合物+同源靶标RNA+AMP-PnP(ATP类似物),并得到了两种状态的Cryo-EM结构,简称AMPPnP1(2.41Å)和AMPPnP2(2.68Å)。在此复合物的基础上再加上一条单链的polyT DNA,作者同样得到了两种Cryo-EM结构(polyT1,3.07Å和polyT2,3.14Å)。在这些结构中,Cmr3颈环结构呈现不同的构像变化,“延伸”、“回缩”和“不可见”。
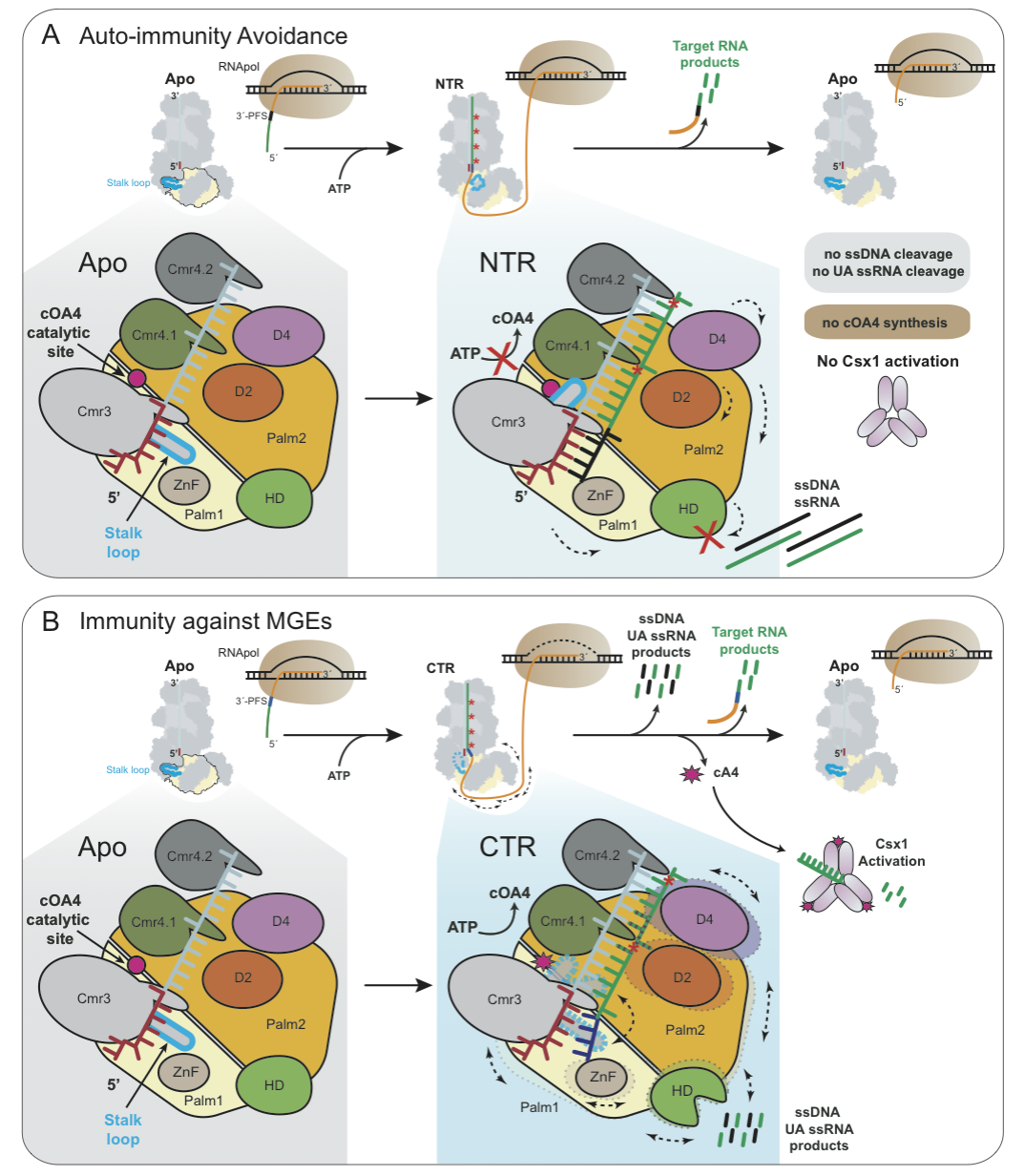
图2
综上所述,不同状态下的多种结构中的颈环结构的构象变化表明,Cmr-β复合物在结合同源靶标RNA后,颈环结构在“延伸”和“回缩”的构型间交替,这种动态平衡似乎控制着Cmr2的活性,从而控制着免疫反应。该研究通过冷冻电镜技术解析了冰岛硫化叶菌中的Cmr-β复合物与不同底物结合后的七种高分辨率结构,结合生化实验数据表征该III-B CRISPR-Cas系统结合靶标RNA后,颈环结构的构象变化参与机体避免自身免疫以及响应免疫的机制。该研究为全面了解多样性的III型CRISPR-Cas系统的免疫机制提供了参考。
我校生命科学技术学院博士毕业生冯明霞为共同第一作者,佘群新教授和哥本哈根大学蛋白质研究中心Guillermo Montoya教授为该研究的共同通讯作者,Guillermo Montoya组的Nicholas Sofos(博士后)与佘群新教授组冯明霞博士为共同第一作者,我校生命科学技术学院李英俊博士也参与了该工作。
2019年,佘群新教授组与Guillermo Montoya教授组合作还在Nature Communications上发表了题为“Structure of Csx1-cOA4 complex reveals the basis of RNA decay in Type III-B CRISPR-Cas”的研究论文(冯明霞博士为共同第一作者),解析了III-B型CRISPR-Cas系统Csx1-cOA4复合体结构并揭示其切割RNA的机制。
原文链接:

