南湖新闻网讯(通讯员 于樾) 近日,华中农业大学作物遗传改良全国重点实验室、湖北洪山实验室周道绣课题组在Nature plants上发表了题为“Lysine acetylation of the histone acetyltransferase adaptor protein ADA2 is a mechanism of metabolic control of chromatin modification in plants”的研究论文,首次揭示了细胞通过能量代谢活动,感知植物生长环境的变化,反馈调节组蛋白乙酰转移酶活性,稳态调控染色质结构和基因表达的分子机制;建立了植物通过代谢活动调控染色质修饰与环境相适应的调控网络。

染色质修饰,特别是组蛋白乙酰化,在应答环境变化的基因表达调控机制中起重要的作用。组蛋白乙酰化是由组蛋白乙酰转移酶(HAT),用乙酰辅酶A作底物,对染色质组蛋白赖氨酸进行的共价修饰。除组蛋白外,细胞中大量的参与其它途径的蛋白质也存在乙酰化修饰。用于赖氨酸乙酰化修饰的乙酰辅酶A主要来源于细胞糖代谢途径。过去的研究认为细胞能量代谢水平会影响染色质修饰和相关基因的表达。如在细胞高能量水平下,染色质乙酰化程度提高,刺激细胞增生相关基因表达,促进细胞分裂。在细胞能量水平下降的胁迫环境中,染色质乙酰化修饰的动态平衡也能被维持,并且逆境相关基因的乙酰化修饰水平得到增强。目前,组蛋白乙酰转移酶(HAT)感知细胞能量代谢 (即乙酰辅酶A)水平的变化的生化基础,以及调控染色质修饰的动态平衡的机制还不清楚。
GCN5 是一种主要的组蛋白乙酰转移酶 (HAT),该酶可以与ADA2等辅助蛋白形成所谓的SAGA复合物,在染色质修饰和重塑中其重要的作用。过去的研究发现ADA2可以增强GCN5与乙酰辅酶A的结合力来激活其活性,修饰染色质组蛋白。在这项研究中,作者通过质谱分析和生物化学、分子生物学等手段验证发现水稻 ADA2 多个赖氨酸位点存在乙酰化修饰,主要由GCN5 催化。通过分析发现 ADA2乙酰化影响其蛋白的稳定性和在细胞中的积累:即 ADA2 高乙酰化不利于其稳定性。通过生物信息及生化分析发现 一个E3 泛素连接酶能特异性的结合并泛素化带有乙酰化修饰的 ADA2 蛋白,导致ADA2蛋白的降解。
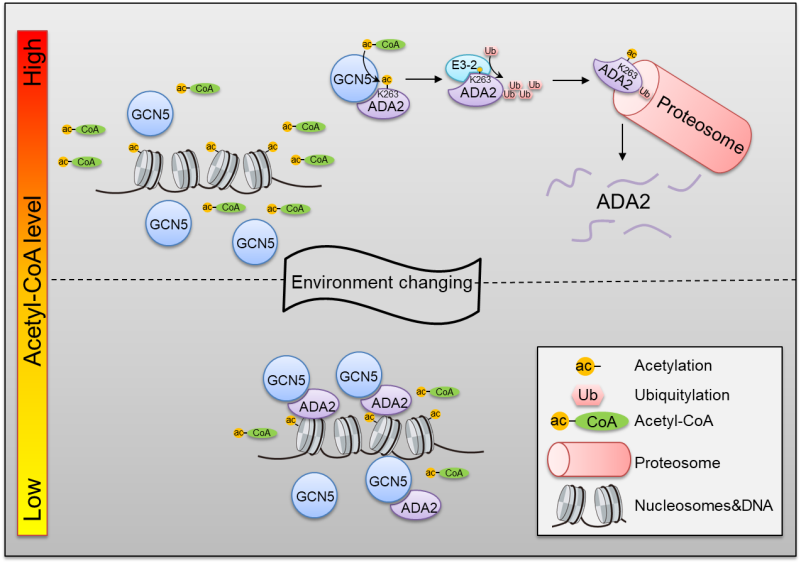
图1 ADA2 感知乙酰辅酶A变化,调节 HAT 活性和组蛋白乙酰化平衡的分子机制
为了探究 ADA2 乙酰化修饰的生物学功能,本研究作者在不同生长条件下(淹水,干旱,白天/黑夜)和一系列相关基因突变体中发现水稻细胞内乙酰辅酶A水平因环境变化而波动,与ADA2乙酰化修饰呈正相关,而ADA2乙酰化修饰程度与其蛋白质水平呈负相关。之后,作者运用在团队前期在植物细胞中建立的由柠檬酸裂解酶介导的乙酰辅酶A合成体系, 进一步验证了乙酰辅酶A的积累能增加 ADA2 的乙酰化,进而减少ADA2蛋白质的积累水平。通过体外和体内GCN5对组蛋白乙酰化酶活实验发现,在高水平乙酰辅酶A的情况下,GCN5 的组蛋白乙酰化酶活并不依赖ADA2;而在低水平乙酰辅酶A的情况下,ADA2的积累可以增强GCN5对乙酰辅酶A的捕捉,从而维持 GCN5 的酶活。 通过对ADA2 基因的敲除和用蛋白泛素化抑制剂MG132 处理等方法,发现植物中乙酰辅酶A水平正常情况下,ADA2 的敲除并不影响总体组蛋白乙酰化水平;但在乙酰辅酶A降低(如干旱等逆境处理)情况下, ada2 突变则抑制了逆境诱导相关基因的乙酰化修饰和表达。而MG132 处理则增强了ADA2 的积累,导致逆境诱导基因的乙酰化修饰和表达的进一步提高。
综上所述,在本研究发现ADA2 赖氨酸乙酰化,控制其蛋白在细胞中的积累水平,影响组蛋白乙酰转移酶活性,是感知植物在不同生长条件下细胞能量 (乙酰辅酶A)水平的变化调控染色质修饰动态平衡和基因表达的机制。这一研究解析了植物通过能量代谢动态控制染色质修饰和基因表达,迅速适应生长环境变化的反馈调控机制。
华中农业大学作物遗传改良全国重点实验室、湖北省洪山实验室和生命科学技术学院博士研究生于樾为论文第一作者,周道绣教授为文章通讯作者,赵毓教授为本研究的工作提供了指导和帮助。博士研究生赵峰、岳亚萍也参与了该研究工作。该研究得到国家自然科学基金项目、中央高校基本科研业务费等资助。
英文摘要:
Histone acetylation is a predominant active chromatin mark deposited by histone acetyltransferases (HATs) that transfer the acetyl group from acetyl coenzyme A (acetyl-CoA) to lysine ε-amino groups in histones. GCN5 is one of the best characterized HATs, which functions in association with several adaptor proteins such as ADA2 within multiprotein HAT complexes. ADA2/GCN5 interaction increases GCN5 binding to acetyl-CoA and stimulates the HAT activity. It remains unclear whether the GCN5 HAT activity that acetylates not only histones but also cellular proteins is regulated by acetyl-CoA levels that vary greatly in cells under different metabolic and nutrition conditions. In this work, we show that the ADA2 protein itself is acetylated by GCN5 in rice cells. Lysine acetylation exposes ADA2 to a specific E3 ubiquitin ligase and reduces its protein stability. In rice plants, ADA2 protein accumulation reversely parallels its lysine acetylation and acetyl-CoA levels, both of which are dynamically regulated under varying growth conditions. Stress-induced ADA2 accumulation could stimulate GCN5 HAT activity to compensate for the reduced acetyl-CoA levels for histone acetylation. The results indicate that ADA2 lysine acetylation that senses cellular acetyl-CoA variations is a mechanism to regulate the HAT activity and histone acetylation homeostasis in plants under the changing environments.
原文链接:https://www.nature.com/articles/s41477-024-01623-0
审核人:赵毓
