南湖新闻网讯(通讯员 胡军) 近日,The ISME Journal杂志在线发表了我校农业微生物资源发掘与利用全国重点实验室、教育部动物育种与健康养殖前沿科学中心、湖北洪山实验室晏向华教授课题组的研究成果,论文题为“Characterizing core microbiota and regulatory functions of the pig gut microbiome”。该研究构建了猪肠道微生物参考基因集,筛选到猪肠道核心优势细菌,并解析其对宿主代谢的调控作用机制,对实施肠道菌群干预改善猪生长与肠道健康具有重要意义。
我国是生猪养殖大国,生猪存栏量居世界首位,拥有70多个地方猪品种,具有丰富的地方猪资源。已有研究表明肠道微生物与猪的腹泻抗性、饲料转化效率、肉品质和免疫功能等重要表型具有密切联系。然而,针对我国特色地方猪肠道微生物资源的发掘与利用仍显不足。因此,全面系统地解析我国猪肠道微生物区系的组成与功能对发掘功能微生物和解析其与宿主的互作机制具有重要意义。
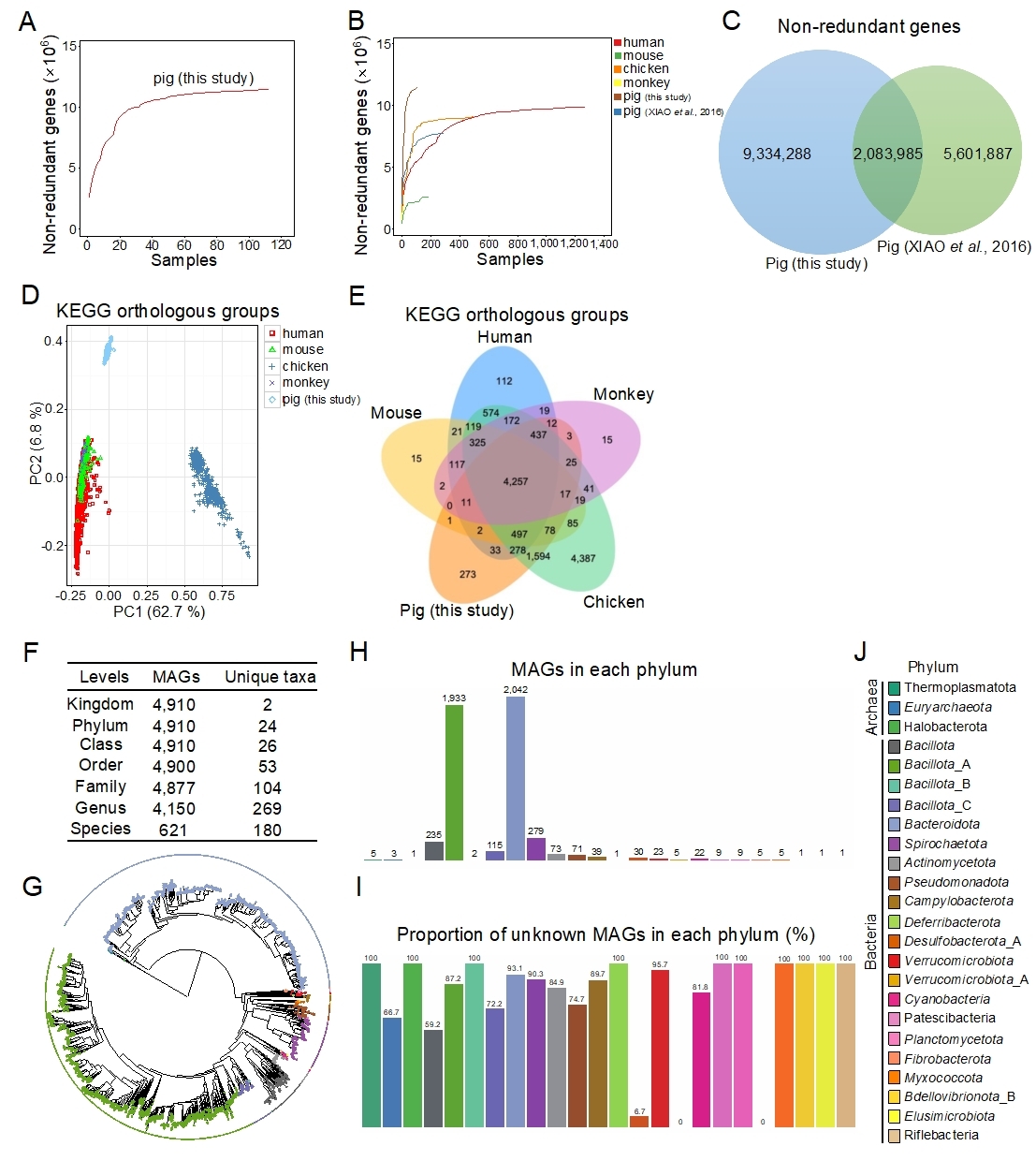
研究人员综合运用宏基因组学和细菌16S rDNA扩增子测序技术系统解析了7个品种猪(即杜×(长×大)猪、藏猪、莱芜猪、沙子岭猪、从江香猪、环江香猪和宁乡猪)共计56头断奶仔猪和56头育肥末期猪的肠道微生物区系组成。鉴定了11418273个非冗余肠道微生物基因,通过与已发表文献的非冗余肠道微生物基因进行整合,本研究构建了包含17020160个非冗余基因的猪肠道微生物基因集,通过对宏基因组组装数据进行分箱,共重构获得了4910个非冗余原核微生物基因组。研究表明我国地方猪肠道微生物的营养物质(包括脂类、氨基酸、碳水化合物和核苷酸)代谢能力和能量代谢能力比杜×(长×大)商品猪更强。杜×(长×大)商品猪肠道微生物的抗生素抗性基因丰度比中国地方猪更高,研究发现品种和日龄是影响猪肠道微生物区系组成和功能的关键因素。综合评估微生物的出现率、微生物相对丰度和猪生长阶段,利用宏基因组学和细菌16S rDNA扩增子测序共鉴定出3种猪肠道核心优势细菌(Phascolarctobacterium succinatutens、Prevotella copri和Oscillibacter valericigenes),结果表明灌服上述3种核心优势细菌可显著增加无菌小鼠的器官指数(包括心脏、脾脏和胸腺),降低胃肠道的长度,增强肠道上皮屏障功能,增加肠道的隐窝深度,同时上述3种核心优势细菌可显著改变无菌小鼠的营养物质代谢过程(包括初级胆汁酸的生物合成、苯丙氨酸、酪氨酸和色氨酸的生物合成、苯丙氨酸的代谢等)。综上,本研究系统性解析了7个品种猪的肠道微生物的组成与功能,筛选出猪肠道微生物核心优势细菌并证明了其对无菌小鼠器官指数、肠道屏障功能、肠道黏膜形态和营养物质代谢的关键调控作用,为实施肠道菌群干预改善猪生长与肠道健康提供理论依据和新资料。
华中农业大学博士后胡军为第一作者,王湘如教授和晏向华教授为共同通讯作者。本研究由华中农业大学生猪精准饲养团队牵头,联合贵州大学张勇副教授、中国科学院亚热带农业生态研究所孔祥峰研究员、湖南农业大学黄兴国教授和中国农业科学院深圳农业基因组研究所唐中林研究员开展系统性研究,是一个多方协同攻坚的成果。本研究得到国家自然科学基金、博士后创新人才计划、博士后面上项目、湖北省自然科学基金的资助。
英文摘要:
Domestic pigs (Sus scrofa) are the leading terrestrial animals used for meat production. The gut microbiota significantly affect host nutrition, metabolism, and immunity. Hence, characterization of the gut microbial structure and function will improve our understanding of gut microbial resources and the mechanisms underlying host-microbe interactions. Here, we investigated the gut microbiomes of seven pig breeds using metagenomics and 16S rRNA gene amplicon sequencing. We established an expanded gut microbial reference catalog comprising 17,020,160 genes and identified 4,910 metagenome-assembled genomes (MAGs). We also analyzed the gut resistome to provide an overview of the profiles of the antimicrobial resistance genes in pigs. By analyzing the relative abundances of microbes, we identified three core-predominant gut microbes (Phascolarctobacterium succinatutens, Prevotella copri, and Oscillibacter valericigenes) in pigs used in this study. Oral administration of the three core-predominant gut microbes significantly increased the organ indexes (including the heart, spleen, and thymus), but decreased the gastrointestinal lengths in germ-free (GF) mice. The three core microbes significantly enhanced intestinal epithelial barrier function and altered the intestinal mucosal morphology, as was evident from the increase in crypt depths in the duodenum and ileum. Furthermore, the three core microbes significantly affected several metabolic pathways (such as “steroid hormone biosynthesis”, “primary bile acid biosynthesis”, “phenylalanine, tyrosine and tryptophan biosynthesis”, and “phenylalanine metabolism”) in GF mice. These findings provide a panoramic view of the pig gut microbiome and insights into the functional contributions of the core-predominant gut microbes to the host.
审核人:王湘如 晏向华
