南湖新闻网讯(通讯员 郑子龙)近日,农业微生物学全国重点实验室、湖北洪山实验室、我校动物育种与健康养殖前沿科学中心晏向华教授团队研究成果以“Lysine crotonylation regulates leucine-deprivation-induced autophagy by a 14-3-3ε-PPM1B axis”为题在Cell Reports发表,研究揭示了亮氨酸通过赖氨酸巴豆酰化修饰途径调节自噬起始过程的分子机制。
生猪精准饲养的重要前提之一是尽可能多地解析营养物质在体内的消化、吸收和代谢过程中的生化代谢途径及其营养生理功能。亮氨酸作为猪必需氨基酸之一,主要功能之一是作为底物参与蛋白质合成,近年还发现其可作为信号分子参与营养物质代谢过程。当机体处于亮氨酸饥饿等营养物质缺乏的应激状态时,自噬过程会被激活,自噬体包裹待降解的底物与溶酶体融合,内容物在溶酶体水解酶的作用下被降解,降解产生的小分子营养物质会重新被机体吸收利用,以满足应激条件下的营养需要,维持机体稳态。亮氨酸饥饿诱导的自噬过程受到多种蛋白质翻译后修饰的严格调控,然而是否有新型翻译后修饰形式参与其中尚不清楚。
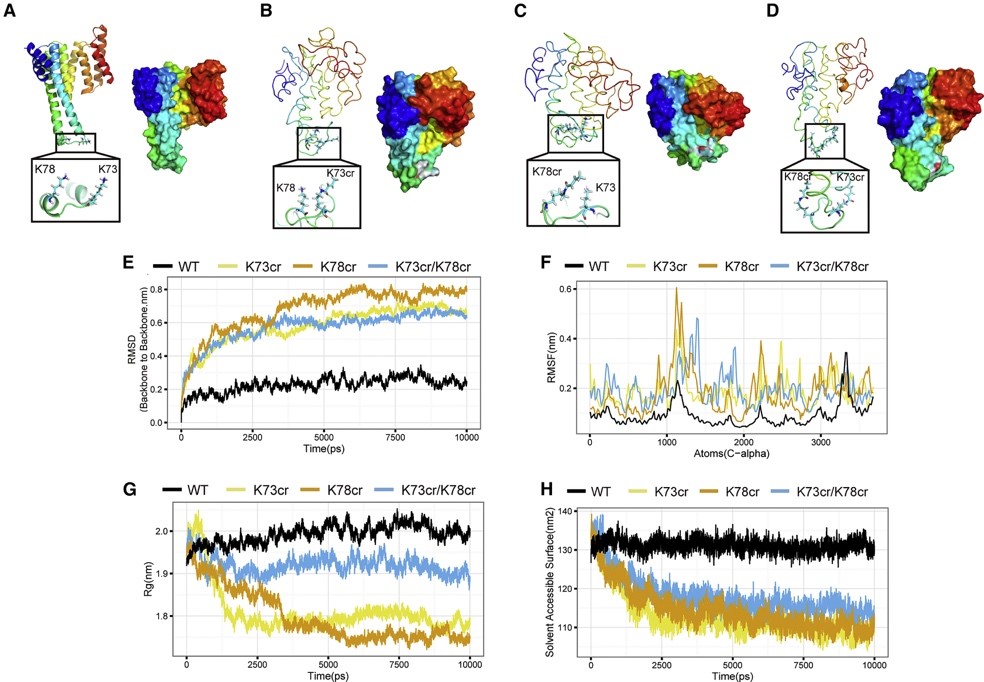
研究人员首先鉴定到亮氨酸饥饿过程中赖氨酸巴豆酰化修饰显著上调,当饲喂亮氨酸饥饿日粮一周后动物肝脏巴豆酰化修饰水平亦显著增加。巴豆酰化修饰激活剂NaCr处理提高巴豆酰化修饰的同时,会激活细胞自噬过程的发生。因此,这一结果提示巴豆酰化修饰在体外或体内都与自噬水平呈现正相关的关系。
接下来,研究人员通过赖氨酸巴豆酰化修饰蛋白质组学鉴定到了一系列受亮氨酸调控的巴豆酰化修饰蛋白。通过生物信息学数据及验证试验,进一步发现14-3-3ε 蛋白的K73和K78巴豆酰化修饰可能在亮氨酸饥饿诱导自噬过程中发挥重要作用。14-3-3ε蛋白巴豆酰化缺失突变K73R和K78R可显著抑制细胞自噬过程的发生。通过14-3-3ε蛋白巴豆酰化修饰分子动力学模拟试验,K73和K78巴豆酰化修饰可显著增加蛋白质分子构象不稳定性,使蛋白质分子二级结构处于一种无序的状态。
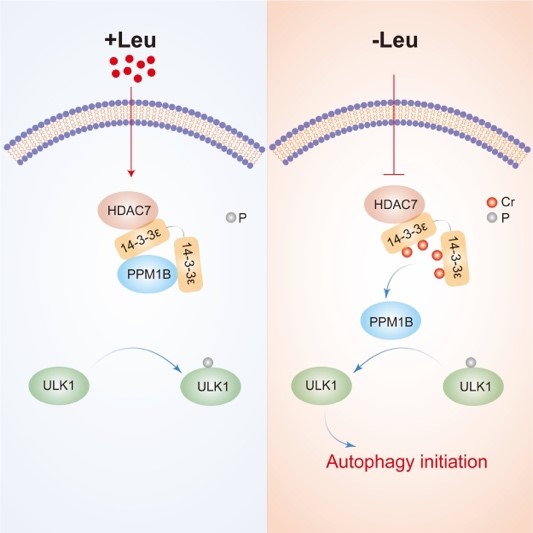
最后,研究人员鉴定到PPM1B蛋白是14-3-3ε蛋白下游效应分子,该蛋白与14-3-3ε蛋白的互作会在亮氨酸饥饿处理后消失,PPM1B与14-3-3ε的互作又受到HDAC7调节的巴豆酰化修饰的调控,而PPM1B是自噬起始因子ULK1的磷酸酶。综上,该研究揭示了亮氨酸缺失首先抑制HDAC7活性,上调14-3-3ε蛋白的巴豆酰化修饰水平,促使PPM1B蛋白与其发生解离,释放的PPM1B去磷酸化ULK1,进而激活自噬起始过程的发生的分子机制,为生猪精准饲料配方设计提供理论基础。
农业微生物学全国重点实验室、湖北洪山实验室、动物育种与健康养殖前沿科学中心博士研究生郑子龙为第一作者,上海交通大学医学院钟清教授和华中农业大学动物科技学院动物医学院晏向华教授为共同通讯作者。该研究受到了国家自然科学基金、国家重点基础研究项目(“973”计划)的资助。
审核人:晏向华
【英文摘要】
Lysine crotonylation as a protein post-translational modification regulates diverse cellular processes and functions. However, the role of crotonylation in nutrient signaling pathways remains unclear. Here, we find a positive correlation between global crotonylation levels and leucine-deprivation-induced autophagy. Crotonylome profiling identifies many crotonylated proteins regulated by leucine deprivation. Bioinformatics analysis dominates 14-3-3 proteins in leucine-mediated crotonylome. Expression of 14-3-3ε crotonylation-deficient mutant significantly inhibits leucine-deprivation-induced autophagy. Molecular dynamics analysis shows that crotonylation increases molecular instability and disrupts the 14-3-3ε amphipathic pocket through which 14-3-3ε interacts with binding partners. Leucine-deprivation-induced 14-3-3ε crotonylation leads to the release of protein phosphatase 1B (PPM1B) from 14-3-3ε interaction. Active PPM1B dephosphorylates ULK1 and subsequently initiates autophagy. We further find that 14-3-3ε crotonylation is regulated by HDAC7. Taken together, our findings demonstrate that the 14-3-3ε-PPM1B axis regulated by crotonylation may play a vital role in leucine-deprivation-induced autophagy.
论文链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(22)01742-9

